Wykrycie zaburzeń genetycznych to lepsza diagnoza i leczenie
W znacznej części przypadków, czas życia chorych ze szpiczakiem coraz bardziej zbliża się do czasu przeżycia populacji osób zdrowych. Jest jednak wyjątek: około 20% stanowią chorzy wysokiego ryzyka, którzy nie korzystają w pełni ze skuteczności leków, ze względu na obecność u nich niekorzystnych zaburzeń cytogenetycznych. I okazuje się, że tylko leczenie zindywidualizowane jest dla nich optymalne.
Cytogenetyka to dział genetyki zajmujący się badaniem chromosomów, czyli struktur, które zawierają informację genetyczną. Badanie cytogenetyczne ma na celu sprawdzenie liczby i struktury chromosomów. Każdą różnicę w stosunku do prawidłowego zapisu czyli mutację chromosomową oznacza się, określając dokładnie rodzaj zmiany oraz jej lokalizację. Badanie cytogenetyczne jest bardzo ważnym elementem diagnostyki szpiczaka plazmocytowego, wpływającym na podjęcie decyzji o zastosowaniu odpowiedniego leczenia.
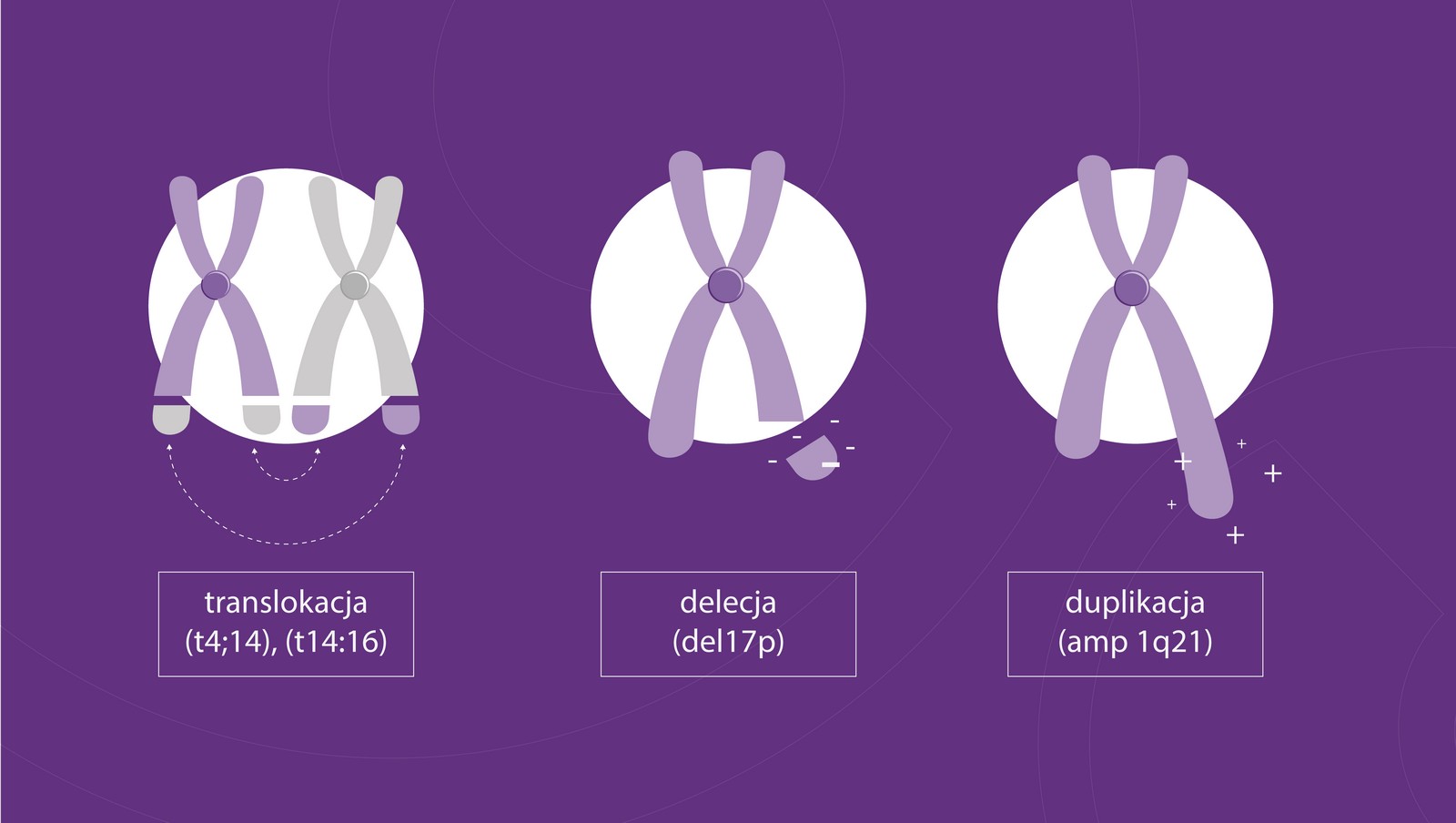
Przeprowadzona ambulatoryjnie w znieczuleniu biopsja szpiku pozwala na postawienie diagnozy i dokładniejsze opisanie komórek szpiczaka. Na stwierdzenie ich obecności pozwala analiza chromosomów, czyli materiału genetycznego znajdującego się w każdej komórce. Badanie cytogenetyczne pozwala lekarzowi odnaleźć anomalie w budowie chromosomów (zaburzenia, czyli mutacje), zwracając uwagę na trzy ich rodzaje: translokacje, delecje i duplikacje.
Translokacje powstają w wyniku przemieszczenia się fragmentu chromosomu. Zazwyczaj zachodzi zamiana fragmentów chromosomów między dwoma chromosomami. W delecji dochodzi do utraty fragmentu chromosomu. Duplikacje są wówczas, gdy fragmenty chromosomu lub całe chromosomy – jak np. w trisomii – ulegają podwojeniu. Translokacje mają bardzo duże znaczenie – w ich wyniku miliony komórek mogą stać się onkogenne.
Typowymi przykładami zmian w przypadku MM są translokacja 4:14 (t4;14), translokacja 14:16 (t14:16), delecja w chromosomie 17 (del(17p).
Wraz z rozwojem nauki, w diagnostyce pojawiają różne metody służące ocenie negatywnych zaburzeń cytogenetycznych, są to m.in.:
- „klasyczna” cytogenetyka (metafazowe chromosomy, oceniane wstępnie przy użyciu skomplikowanych mikroskopów, programów komputerowych itd., a na końcu analizowane przez doświadczonego cytogenetyka)
- metoda FISH (Fluorescence In Situ Hibridization),
- metoda CGH (Comparative Genomic Hybridization),
- metoda SNP (Single Nucleotide Polymorphism) i inne.
W celu uzyskania pełnego obrazu choroby, Polska Grupa Szpiczakowa zaleca wykorzystywanie zarówno danych klinicznych jak i diagnostyki cytogenetycznej, a w tym celu wykonywanie badań genetycznych metodą cytogenetyki klasycznej oraz metodą FISH - obie są źródłem informacji o biologii choroby, a tym samym pośrednio o rokowaniu. Wyodrębnienie w ten sposób dobrze zdefiniowanych podtypów choroby i – w związku z tym – ocena stopnia ryzyka w jej przebiegu pozwalają na adekwatne leczenie. Także Międzynarodowa Grupa Robocza ds. Szpiczaka Mnogiego zaleca wykrywanie zaburzeń genetycznych, uważając je za pożyteczne dla analiz sytuacji klinicznej (oceny ryzyka) – w chwili rozpoznania choroby i każdorazowo w przypadku jej wznowy lub progresji.
Wykonanie odpowiednich badań i w ich wyniku stwierdzenie obecności zaburzeń genetycznych (jako czynników rokowniczych) pozwala lekarzowi na wybór terapii indywidualnie dostosowanej do danego chorego, według zaleceń stworzonych m.in. przez Mayo Clinic (Mayo Startification of Myeloma and Risk-Adopted Therapy - mSMART). Określenie grup ryzyka opiera się tu na ocenie zaburzeń cytogenetycznych w komórkach szpiczaka oraz ich wpływu na odpowiedź na poszczególne schematy terapeutyczne. Wyniki tej analizy mają szczególne znaczenie również dla chorego, dając wyobrażenie o przebiegu choroby oraz o rokowaniach.
Klasyfikacja ryzyka cytogenetycznego – jakie jest rokowanie?
Wyniki biopsji szpiku wykorzystywane są do oceny stopnia ryzyka cytogenetycznego. Na podstawie jej wyniku można zaklasyfikować chorego do grupy rokowniczej.
Metody stratyfikacji ryzyka dzielą się na:
- zależne od pacjenta (wiek, stan fizyczny, choroby towarzyszące)
- zależne od nowotworu (ze względu na biologię choroby) – masa guza, czy choroba zajmuje obszary pozaszpikowe (nacieczenie pozaszpikowe), czy jest to białaczka plazmatycznokomórkowa, czy nowotwór odznacza się wysoką aktywność metaboliczną (wysoki indeks proliferacyjny); aktywność nowotworu: beta2 mikroglobulina, albumina, LDH (aktywność metaboliczna choroby wynika z obecności zaburzeń genetycznych).
Nawrót choroby to wskazanie do ponownego badania genetycznego
W przebiegu szpiczaka plazmocytowego w miarę upływu czasu oraz w wyniku leczenia farmakologicznego mogą wystąpić nowe genetyczne zmiany, dlatego komórki szpiczaka nie powinny być określane jedynie podczas pierwszego badania cytogenetycznego, ale też w związku z nawrotem. Gdy ponownie wzrasta aktywność choroby i konieczne jest dostosowanie terapii farmakologicznej, zaleca się wykonanie ponownej biopsji szpiku kostnego.
Uważa się bowiem, że te same genetyczne czynniki rokownicze uznane za niekorzystne w momencie rozpoznania również niekorzystnie wpływają na przebieg choroby w momencie jej progresji lub wznowy. Chory w chwili rozpoznania choroby kwalifikowany do grupy niskiego ryzyka, w sytuacji pojawienia się niekorzystnego czynnika rokowniczego powinien być zaklasyfikowany do grupy o gorszym rokowaniu i odpowiednio leczony.
Pacjent w grupie wysokiego ryzyka cytogenetycznego
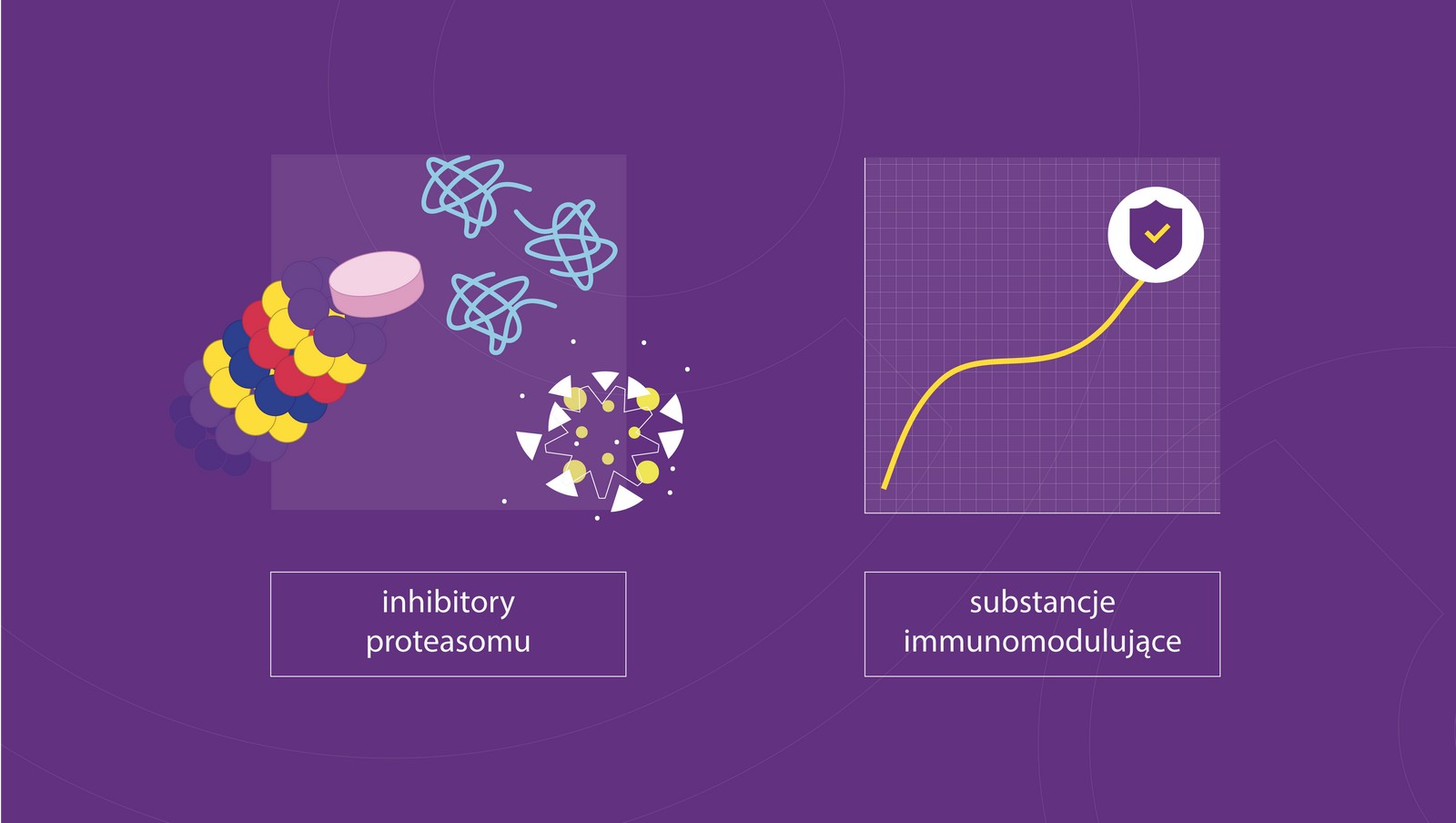
W przypadku pacjentów, u których wchodzi w grę terapia wysokodawkowa z przeszczepieniem komórek macierzystych (przeszczep autologiczny), wynik badania cytogenetycznego może mieć wpływ na podjęcie decyzji, czy należy zastosować jedną czy dwie terapie wysokodawkowe. Nawet jeśli się okaże, że pacjent należy do grupy tych 20% pacjentów ze stwierdzoną obecnością niekorzystnego w szpiczaku zaburzenia genetycznego utrudniającego leczenie, i wobec tego ma złe rokowanie – zyskujemy możliwość dokładniej celowanej terapii. Można zastosować leczenie, korzystając z zaleceń różnych grup badawczych proponujących określone schematy terapeutyczne w leczeniu chorych z wysokim ryzykiem cytogenetycznym. Nieustannie poszukuje się skuteczniejszych schematów, ze względu na to, że wyniki ich terapii są gorsze od wyników uzyskiwanych w grupie pacjentów z ryzykiem standardowym. U pacjentów znajdujących się w grupie wysokiego ryzyka cytogenetycznego określone sposoby leczenia – na przykład terapie skojarzone z użyciem inhibitorów proteasomów i leków immunomodulujących, okazały się być odpowiednio dostosowane.
Inhibitory proteasomów to leki, które blokują rozpad białka, w szczególności komórek szpiczaka, prowadząc w ten sposób do ich obumierania. Substancje immunomodulujące pobudzają układ odpornościowy do walki z komórkami szpiczaka.
Uważa się, że największe korzyści z intensyfikacji leczenia (w postaci łączenia leków z nowych grup) odnoszą chorzy standardowego ryzyka. U chorych wysokiego ryzyka odnotowuje się poprawę̨ wyników leczenia, ale większość - nawet tych najnowocześniejszych leków - nie niweluje u nich całkowicie niekorzystnego wpływu wszystkich czynników ryzyka. Należy jednak podkreślić, że sytuacja chorych na szpiczaka w ostatnich latach uległa poprawie. Stosowane leczenie przynosi coraz lepsze efekty i stało się bardziej dostępne. Ostatnie lata przyniosły również nowe możliwości w ramach programu lekowego. Coraz lepsza znajomość specyfiki choroby, czynników wpływających na jej rozwój i dostępne terapie mogą dawać nadzieję na postęp, który umożliwi kolejne, dobre zmiany i tym samym skuteczniejsze leczenie, w szczególności dla osób z grupy wysokiego ryzyka.
PL/IXZ/20/0027