Przeciwciała monoklonalne w leczeniu chorych na chłoniaki
- Lekarze nie wyobrażają sobie leczenia chłoniaków bez stosowania przeciwciał monoklonalnych, które są jednymi z najskuteczniejszych leków przeciwnowotworowych.
- Przeciwciała monoklonalne mogą być bezpiecznie stosowane w połączeniu z chemioterapią, ale są skuteczne w monoterapii, czyli podawane samodzielnie.
- Pierwszym przeciwciałem zarejestrowanym do leczenia chorób onkologicznych był/jest rytuksymab – przeciwciało monoklonalne antyCD20.
- Antygen CD20 obecny na komórkach chłoniaków z komórek B jest dobrym celem dla terapii przeciwnowotworowej – skonstruowano kolejne odmiany przeciwciał monoklonalnych usuwające komórki nowotworowe za pośrednictwem tej cząsteczki.
- Nowoczesne technologie umożliwiły połączenie w jednej cząsteczce działającego specyficznie przeciwciała monoklonalnego i leku cytotoksycznego – tak powstał pierwszy zarejestrowany koniugat lek/przeciwciało – Brentuksymab Vedotin.
Przeciwciała
Przeciwciała są białkowymi cząsteczkami produkowanymi przez dojrzałe limfocyty B. Ich główną rolą jest obrona organizmu przed bakteriami, wirusami, pasożytami, ale także nieprawidłowymi komórkami nowotworowymi.
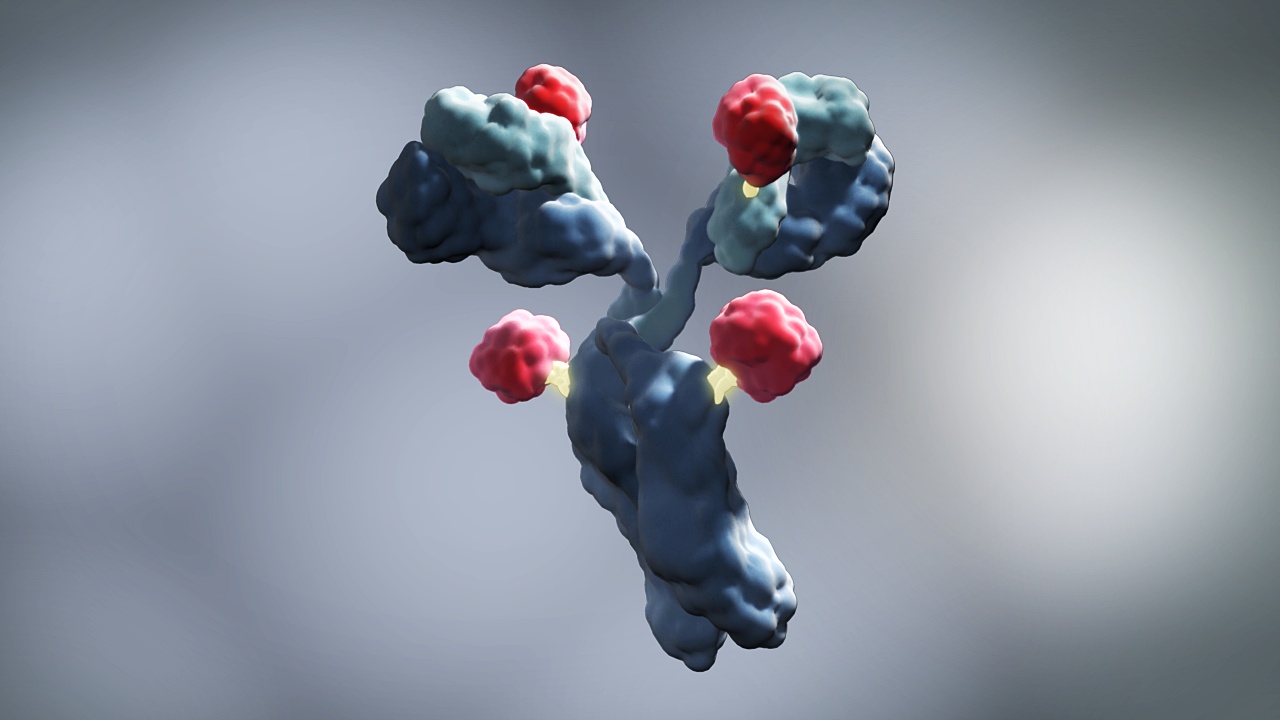
Kształtem przeciwciała przypominają literę Y, której podstawę stanowi miejsce nazwane fragmentem FC, zaś dwa górne końce to fragmenty FAB. Połączenie części FAB z FC jest elastyczne (tak zwany rejon zawiasowy), umożliwiając końcówkom FAB łatwiejsze dotarcie do „obcych”, „nieprawidłowych” cząsteczek - antygenów. Końcami FAB przeciwciała łączą się z antygenami, zaś stabilna końcówka FC powiadamia o tym układ odpornościowy. To zapoczątkowuje m.in. takie zjawiska, jak fagocytozę – czyli zniszczenie przyłączonej do przeciwciała cząsteczki przez własne komórki odpornościowe organizmu.
Ryc. 1. Budowa przeciwciała
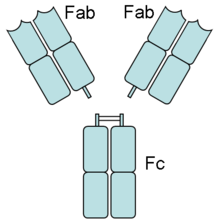
Źródło: https://szkolnictwo.pl/szukaj,Przeciwcia%C5%82o
Sposób działania przeciwciał monoklonalnych
Przeciwciała monoklonalne syntetyzowane za pomocą skomplikowanych medycznych technologii budową i funkcją przypominają ludzkie naturalne przeciwciała. Na końcach FAB mają wbudowane specyficzne fragmenty łączące się z konkretnymi epitopami, czyli fragmentami poszukiwanych obcych lub szkodliwych dla organizmu antygenów. Właśnie dlatego, że przeciwciała te rozpoznają tylko konkretne komórki nazywane są przeciwciałami monoklonalnymi (mono – pojedynczy).
Przeciwciała monoklonalne podane są do krwiobiegu we wlewie dożylnym lub do układu naczyń limfatycznych drogą podskórną. Przesuwając się w układzie naczyniowym organizmu, odnajdują konkretne komórki nowotworowe i zapoczątkowują liczne zjawiska obronne w organizmie. Do wnętrza zidentyfikowanej obcej komórki przeciwciało wysyła sygnał o konieczności jej wyeliminowania. Dochodzi do aktywacji mechanizmu apoptozy – samobójczej śmierci komórki lub przez uwolnienie z organelli komórkowych substancji toksycznych jej lizy. Jeśli w cząsteczce przeciwciała wbudowany jest lek cytostatyczny, zostaje on wstrzyknięty do wnętrza komórki, co jeszcze szybciej doprowadza do jej zniszczenia. Poza tym fragmentem FC przeciwciała monoklonalne „przywołują” odpowiedzialne za walkę z nowotworem własne komórki układu immunologicznego: limfocyty T, NK i wskazują im konkretne komórki nowotworowe przeznaczone do usunięcia – toksyczność związana z własnymi przeciwciałami, mechanizm dopełniacza. Selektywna eliminacja komórek nowotworowych oraz oszczędzanie zdrowych komórek organizmu powoduje u pacjentów mniej ogólnoustrojowych działań niepożądanych i lepszą tolerancję terapii przeciwciałami monoklonalnymi niż chemioterapią.
Przeciwciała monoklonalne anty-CD20
Już na przełomie XIX i XX wieku wiadomo było, że w surowicy krwi znajdują się substancje, odpowiedzialne za mechanizmy obronne organizmu – nazwane następnie przeciwciałami. Wiele lat pracowano nad przełożeniem tego odkrycia na grunt praktycznej medycyny. W 1975 roku Cesar Milstein i Georges Kohler opracowali koncepcję produkcji przeciwciał monoklonalnych, co w latach 90. XX wieku zaowocowało zsyntetyzowaniem pierwszego użytecznego chorym przeciwciała monoklonalnego – Rytuksymabu.
W 1997 roku Rytuksymab jako pierwszy lek celowany w onkologii otrzymał rejestrację do leczenia chorych na chłoniaka grudkowego.
Rytuksymab jest zsyntetyzowanym metodami inżynierii genetycznej chimerycznym ludzko-mysim przeciwciałem monoklonalnym (posiada około 75% strukturę ludzkich przeciwciał). Jego skuteczność i bezpieczeństwo zostały dokładnie zbadane. Na początku u chorych na chłoniaki grudkowe, następnie u chorych na inne chłoniaki z komórek B. W kluczowym przeprowadzonym w wielu ośrodkach opracowaniu z 1998 roku przedstawiono wyniki leczenia Rytuksymabem w monoterapii u chorych na nawrotowego, opornego na leczenie chłoniaka grudkowego. W tej trudnej grupie chorych korzyść po podaniu 4 dawek Rytuksymabu uzyskano u prawie połowy pacjentów (48%), zaś działania niepożądane terapii z wyjątkiem reakcji podczas samego wlewu dożylnego były znikome1.
Ryc. 2. Cząsteczki Rytuksymabu
Ryc. 3. Budowa Rytuksymabu
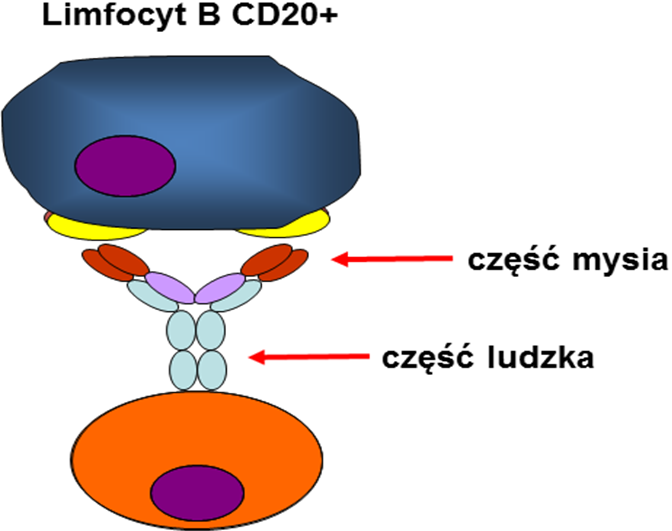
Ponieważ większość chłoniaków z komórek B ma na swojej powierzchni antygen CD20, wskazania do stosowania Rytuksymabu bardzo szybko rozszerzyły się na inne podtypy chłoniaków B komórkowych. W tej chwili nie wyobrażamy sobie leczenia chłoniaków Burkitta, pierwotnych śródpiersia lub chłoniaków strefy brzeżnej czy MALT żołądka bez Rytuksymabu. U chorych na agresywnego chłoniaka rozlanego z dużych komórek B, dołączenie Rytuksymabu do standardowej chemioterapii CHOP o około 20% zwiększyło skuteczność terapii2. Chorzy na chłoniaki indolentne (przewlekłe) w pewnych sytuacjach mogą być leczeni tylko samym przeciwciałem. Rytuksymab stosuje się także u chorych na chłoniaki grudkowe w tzw. leczeniu podtrzymującym po zakończonej właściwej terapii, podając to przeciwciało przez 2-3 lata co 2-3 miesiące. Postępowanie takie zwiększa szanse chorych na długotrwałe zachowanie remisji choroby.
Od czasu pierwszej rejestracji Rytuksymabu kilka milionów chorych otrzymało ten lek. Na przestrzeni lat wiemy, że jest on bezpieczny. Początkowo obawiano się, że może znacznie upośledzać naturalną odporność organizmu, ale te przypuszczenia nie potwierdziły się. Jedyną z nielicznych niedogodności związanych z terapią Rytuksymabem jest występowanie u około 20% chorych reakcji niepożądanych podczas pierwszego wlewu dożylnego lub znacznie rzadziej podczas kolejnych podań. Chorzy mogą doświadczyć różnorodnych, jak na przykład: wystąpienia gorączki, kaszlu, drapania w gardle, może pojawić się wysypka, świąd. Niezwykle rzadko może rozwinąć się niewydolność oddechowa lub poważne objawy uczuleniowe. Na szczęście zastosowanie profilaktyki przeciwzapalnej, przeciwalergicznej i gorączkowej przed rozpoczęciem wlewu, infuzja dożylna trwająca 3-4 godziny oraz uważne monitorowanie pacjenta podczas pierwszego podania zapewnia bezpieczne stosowanie leku. A nawet jeśli wystąpią niepokojące objawy podczas wlewu, to przy szybkim działaniu personelu są one najczęściej całkowicie odwracalne.
Rytuksymab jest i będzie pionierem terapii przeciwciałami monoklonalnymi. Jest także pierwszym przeciwciałem monoklonalnym dopuszczonym do stosowania u chorych na chłoniaki z komórek B w postaci zastrzyku podskórnego.
Preparat Rytuksymabu do iniekcji podskórnej jest zupełnie tym samym lekiem, co postać dożylna. Różni się tylko tym, że na ostatnim etapie syntezy do cząsteczki przeciwciała dołączana jest hialuronidaza – enzym rozkładający kwas hialuronowy. Kwas ten występuje naturalnie w organizmie człowieka, w tkance podskórnej gromadzi wodę i nadaje jej sprężystość i elastyczność. Dla celów wchłaniania leków jest to zjawisko niekorzystne, gdyż zawarta w tkance podskórnej woda utrudnia przechodzenie płynów (w tym leków) do przestrzeni naczyniowej. Jednak jeżeli doraźnie rozerwie się strukturę kwasu hialuronowego, to podawany do takiej przestrzeni płyn/lek/zawiesina szybko się wchłonie, nie napotykając twardego rusztowania kwasu i zbiorników wody. Postać podskórna Rytuksymabu została zsyntetyzowana dzięki technologii Enhanze, która dołączyła hialuronidazę do cząsteczki Rytuksymabu. Podanie leku podskórnie powoduje odwracalne, trwające do 24 godzin rozluźnienie struktury tkanki podskórnej i ułatwione wchłonięcie Rytuksymabu z zastrzyku podskórnego w konsekwencji dezaktywacji kwasu hialuronowego. Także w tym przypadku skrupulatnie sprawdzono skuteczność tej formy leku. Na podstawie licznych klinicznych obserwacji stwierdzono, że jest ona bezpieczna, tak samo skuteczna, jak forma dożylna, a zdecydowanie wygodniejsza dla pacjentów - można podawać ją w zastrzyku trwającym nie więcej niż 10 min.
W Polsce od początku 2017 roku podskórna postać Rytuksymabu jest dostępna dla chorych dorosłych na chłoniaki rozlane z dużych komórek B w skojarzeniu z chemioterapią CHOP oraz w leczeniu chorych na chłoniaki grudkowe w III-IV stopniu klinicznego zaawansowania w skojarzeniu z chemioterapią lub w leczeniu podtrzymującym w terapii pierwszoliniowej lub w nawrocie.
Oprócz Rytuksymabu na przestrzeni ostatnich lat trwają intensywne prace nad udoskonaleniem samej cząsteczki przeciwciał monoklonalnych – aby była jak najbardziej podobna do komórek organizmu, czyli nie wywoływała reakcji nietolerancji ze strony komórek własnych oraz aby jak najprecyzyjniej odnajdywała i mocno przyczepiała się do komórek nieprawidłowych.
Ponieważ technologie medyczne są coraz bardziej zaawansowane przed kilku laty zsyntetyzowano kolejne przeciwciał monoklonalne antyCD20 – Obinutuzumab.
Jest to humanizowane przeciwciało monoklonalne, które w 90% ma strukturę ludzkiego przeciwciała. Modyfikacja grupy cukrowej w rejonie FC kilkadziesiąt razy zwiększyła siłę w porównaniu do Rytuksymabu gromadzenia własnych komórek immunologicznych (limfocyty T, NK, makrofagi, przeciwciała) w miejscu, w którym przeciwciało odnalazło komórkę chłoniaka. Obinutuzumab silniej łączy się z antygenem CD20, przez co skuteczniej od Rytuksymabu indukuje w komórkach nowotworowych apoptozę.
Międzynarodowe zalecenia wskazują zasadność podawania Obinutuzumabu u chorych na chłoniaki grudkowe, u których doszło do niepowodzenia leczenia po wcześniejszym stosowaniu Rytuksymabu z chemioterapią. Ma ono także zastosowanie u chorych na przewlekłą białaczkę limfocytową.
Kolejnym przeciwciałem monoklonalnym powodującym eliminacje komórek nowotworowych przez rozpoznanie ich za pomocą cząsteczki CD20 jest Ofatumumab. Jest to całkowicie ludzkie przeciwciało, którego nie poleca się do rutynowego stosowania u chorych na chłoniaki. Stosuje się je w ściśle określonych sytuacjach u chorych na przewlekłą białaczkę limfocytową.
Oba wyżej wymienione przeciwciała stosuje się w iniekcjach do żył obwodowych, a bezpośrednio przed wlewem należy podać pacjentowi trójlekową premedykację w celu zmniejszenia ryzyka wystąpienia reakcji niepożądanych podczas infuzji leku.
Ryc. 4. Obinutuzumab
Przeciwciało monoklonalne anty-CD30 – Brentuksymab Vedotin
Powszechnie wiadomo, że celem nowoczesnych terapii onkologicznych jest zwiększanie selektywnego działania leków, czyli niszczenia tylko komórek nowotworowych z oszczędzaniem zdrowych oraz coraz efektywniejsza eliminacja komórek nowotworowych. W ostatnim dziesięcioleciu udało się skonstruować i wykazać skuteczność pierwszego przeciwciała monoklonalnego, które nie tylko selektywnie rozpoznaje komórki chłoniaka, ale także skutecznie niszczy je bezpośrednio po identyfikacji, gdyż zawiera dołączony do swojej cząsteczki lek cytotoksyczny.
Jest to koniugat przeciwciała i cytostatyku – Brentuksymab Vedotin, który zbudowany jest z przeciwciała monoklonalnego rozpoznającego cząsteczkę CD30 i leku auristatyny E.
Duże stężenia antygenu CD30 znajdują się na powierzchni komórek nowotworowych chłoniaka Hodgkina oraz chłoniaka anaplastycznego z dużych komórek. Niespecyficznie CD30 może również pojawiać się na aktywowanych limfocytach B i T, ale w takich przypadkach jego stężenia na komórkach jest dosyć niskie.
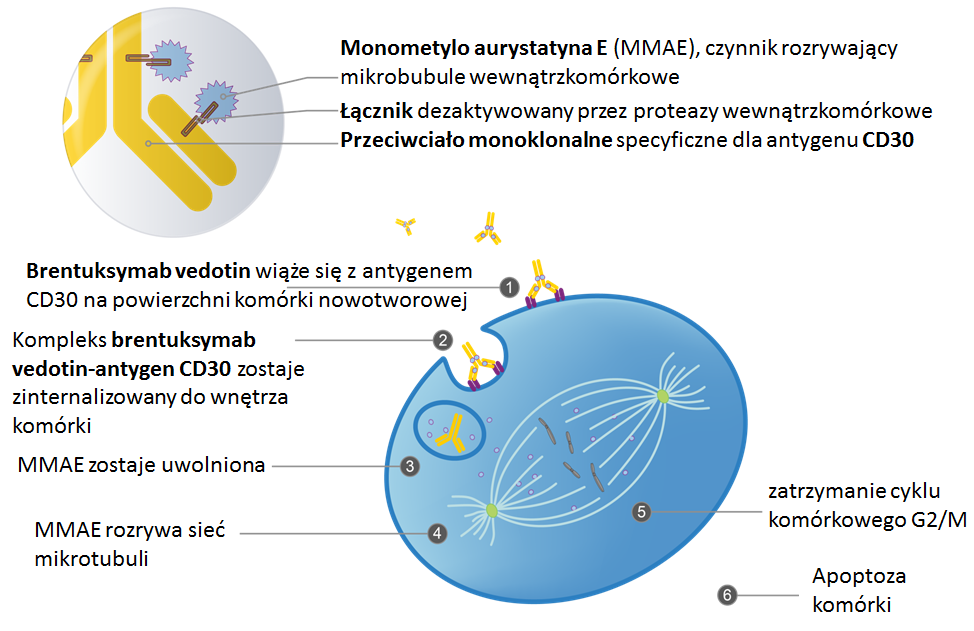
Brentuksymab Vedotin jest ludzkim chimerowym przeciwciałem antyCD30 związanym kowalencyjnie z hamującym w jądrze komórkowym mikrotubule lekiem auristatyną E. Brentuksymab Vedotin znajduje komórkę nowotworową z antygenem CD30 i przyłącza się fragmentem FAB do antygenu CD30 na powierzchni komórki. Następnie przez błonę komórkową dostaje się do środka, gdzie zostaje odłączona auristatyna. Ona powoduje zatrzymanie cyklu komórkowego i samobójczą śmieć komórki. Rozpadająca się komórka uwalnia do środowiska niewielkie ilości auristatyny, wywierając efekt cytotoksyczny na okoliczne komórki guza nowotworowego. Podając Brentuksymab Vedotin we wlewie dożylnym u około 75% chorych, obserwuje się pozytywny efekt pod postacią regresji wielkości powiększonych nowotworowo węzłów chłonnych. Dane te oparte są na wieloośrodkowych obserwacjach chorych na chłoniaka Hodgkina i chłoniaka anaplastycznego z dużych komórek. W badaniu, które było podstawą do rejestracji leku, brali udział chorzy na nawrotową i oporną postać chłoniaka Hodgkina, w tym po autotransplantacji komórek macierzystych krwi obwodowej. W tej wybitnie trudnej do leczenia grupie 34% chorych uzyskało całkowitą remisję choroby, ponad 40% częściową odpowiedź. W 5-letniej obserwacji ponad połowa chorych, którzy uzyskali całkowitą remisję choroby, żyje, co oznacza, że terapia samym tylko Brentuksymabem Vedotin w tej bardzo schorowanej grupie pacjentów była skuteczna.
Podobnie, pacjenci na chłoniaka anaplastycznego z dużych komórek mają około 85% szansy na uzyskanie odpowiedzi po podaniu Brentuksymabu Vedotin, w tym ponad 50% chorych może uzyskać całkowitą remisję chłoniaka.
Ponieważ po zastosowaniu tego przeciwciała zdarzają się nawroty choroby, podobnie, jak w przypadku np. Rytuksymabu, ponowne podanie Brentuksymabu Vedotin może być skuteczne i prowadzić do kolejnej remisji chłoniaka.
Na podstawie prowadzonych od ponad 10 lat badań i obserwacji przedklinicznych i klinicznych obecnie także w Polsce, na podstawie programu lekowego, Brentuksymab Vedotin jest stosowany w leczeniu dorosłych chorych na nawrotowego lub opornego na leczenie chłoniaka Hodgkina, CD30+ po autologicznym przeszczepieniu komórek macierzystych szpiku lub po co najmniej dwóch wcześniejszych terapiach w przypadku, gdy wielolekowa chemioterapia i autoprzeszczepienie nie stanowi opcji leczenia.
Brentuksymab Vedotin możemy także stosować w leczeniu dorosłych chorych na nawrotowego lub opornego na leczenie układowego chłoniaka anaplastycznego z dużych komórek.
Wobec znaczącej skuteczności Brentuksymabu Vedotin obserwowanej w różnych sytuacjach klinicznych u chorych na chłoniaki z cząsteczką CD30 na powierzchni, wskazania do podawania tego przeciwciała na przestrzeni kolejnych lat, a może nawet miesięcy, zostaną prawdopodobnie rozszerzone.
Brentuksymab Vedotin podaje się w 30-minutowych wlewach dożylnych, które na ogół są przez pacjentów dobrze tolerowane. Nie zaleca się rutynowego stosowania leków antyalergicznych i przeciwzapalnych każdorazowo przed podaniem. Wyjątek stanowią sytuacje, gdy u pacjenta wystąpiły niespecyficzne objawy podczas wcześniejszych infuzji leku.
Ponieważ w skład Brentuksyambu Vedotin wchodzi auristatyna, działania niepożądane po jego podaniu zdarzają się częściej niż w przypadku tzw. czystych przeciwciał monoklonalnych. Niemniej są one istotnie mniejsze niż po stosowaniu chemioterapii. Do najczęstszych należy polineuropatia obwodowa (głównie zaburzenie czucia małych końcówek nerwów), która związana jest z działaniem auristatyny i pojawia się u ok. 30 proc. chorych. Może także wystąpić zmniejszenie poziomu białych krwinek i płytek krwi po podaniu leku. Poważne działania niepożądane związane z toksycznością ośrodkowego układu nerwowego są niezmiernie rzadkie, ale rozpoczynając terapię Brentuksymabem Vedotin, powinny być omówione z lekarzem prowadzącym leczenie.
Ryc. 5. Brentuksymab Vedotin
Ryc. 6. Mechanizm działania Brentuksymabu Vedotin
Podsumowanie
Powyższy tekst powstał, aby opisać podstawowe wiadomości o przeciwciałach monoklonalnych stosowanych na co dzień do leczenia pacjentów chorych na chłoniaki. Opracowanie to nie zawiera oczywiście wszystkich informacji. Każdy z nas inaczej postrzega swoją chorobę i potrzebuje innego zakresu wiedzy na jej temat. Dlatego zachęcamy do zadawania pytań bezpośrednio swojemu lekarzowi. A także dopytywania się o nowe zastosowania leków, nowe leki i nowe standardy postępowania. Są one aktualizowane przez lekarzy na całym świecie z dużą częstotliwością. POWODZENIA!
- Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program. McLaughlin P, Grillo-López AJ, Link BK, Levy R, Czuczman MS, Williams ME, Heyman MR, Bence-Bruckler I, White CA, Cabanillas F, Jain V, Ho AD, Lister J, Wey K, Shen D, Dallaire BK.J Clin Oncol. 1998 Aug;16(8):2825-33.
- CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. Coiffier B1, Lepage E, Briere J, Herbrecht R, Tilly H, Bouabdallah R, Morel P, Van Den Neste E, Salles G, Gaulard P, Reyes F, Lederlin P, Gisselbrecht C. N Engl J Med. 2002 Jan 24;346(4):235-42.
- Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Chen R, Gopal AK, Smith SE, Ansell SM, Rosenblatt JD, Savage KJ, Connors JM, Engert A, Larsen EK, Huebner D, Fong A, Younes A. Blood. 2016 Sep 22;128(12):1562-6.