Pani profesor, czy polscy pacjenci chorujący na przewlekłą białaczkę limfocytową mają dostęp do najnowszych terapii zgodnie z wytycznymi Europejskiego Stowarzyszenia Onkologii Klinicznej? Jakie są wytyczne Polskiego Towarzystwa Hematologów i Transfuzjologów dotyczące leczenia tej grupy pacjentów?
Obecne wytyczne polskie zostały opracowane w bieżącym roku. W ciągu ostatnich lat nastąpiło wiele zmian w leczeniu PBL wywołanych pojawieniem się nowych cząsteczek. Do dotychczasowych leków (chlorambucyl, analogi puryn, bendamustyna) doszły nowe cząsteczki, a niektóre nie są stosowane, np. leczenie skierowane przeciw antygenowi CD-52 (alemtuzumab) już nie jest zarejestrowane w terapii PBL. Oprócz pierwszego przeciwciała anty-CD20, rytuksymabu mamy nowe przeciwciało obinutuzumab o silniejszym działaniu. Mamy również nowe inhibitory (terapie celowane). Są to: inhibitory BCR, czyli hamujące przewodzenie przez receptor limfocytu typu B, do których należą inhibitory kinazy Brutona (BTK) takie jak ibrutynib i akalabrutynib i inhibitory PI3K (lek idelalizyb, który nie jest dostępny w Polsce) oraz inhibitory BCL2 (wenetoklaks). Mam nadzieję, że w przyszłości dołączy również terapia CAR-T, nad którą są prowadzone badania. W leczeniu pacjentów z przewlekłą białaczką limfocytową możemy również zastosować transplantację allogeniczną komórek krwiotwórczych, w której wskazania zmieniły się i która wykonywana jest rzadziej w dobie nowych leków.
Nadal, jeśli przewlekła białaczka limfocytowa jest bezobjawowa, nie ma cech progresji, zalecana jest tylko obserwacja pacjenta i tak też postępujemy. Natomiast zmieniło się nie tylko to, że delecja 17p/mutacja typu TP53 jest wskazaniem do leczenia bez chemioterapii, ale należy również ocenić stan mutacyjny genów dla IGVH, czyli części zmiennej łańcucha ciężkiego immunoglobulin i podejmować decyzję na tej podstawie już w pierwszej linii leczenia. Obecnie pacjenci z delecją 17p/mutacją TP53 w ogóle nie powinni otrzymywać chemioterapii. My takiej możliwości nie mamy. Pacjenci z tymi zaburzeniami genetycznymi powinni otrzymywać ibrutynib, akalabrutynib czy wenetoklaks z obinutuzumabem lub idelalizyb. Jeśli nie ma tych leków i są im podawane kortykosteroidy w dużych dawkach i rytuksymab albo alemtuzumab (który zarejestrowany nie jest) lub immunochemioterapia, to stan chorych może ulec pogorszeniu. Nie tylko nie otrzymają skutecznego leczenia, ale mogą otrzymać chemioterapię, która ma wiele działań niepożądanych.
Jeśli chory nie ma delecji 17p/mutacji TP53, postępowanie jest zależne od stanu mutacyjnego genów IGVH. U chorych ze statusem niezmutowanym chemio- czy imunochemioterapia są również mniej skuteczne, odpowiedź na leczenie jest krótsza. Uważa się, że powinni oni otrzymać inne metody leczenia, takie jak: wenetoklaks z obinutuzumabem czy też ibrutynib lub akalabrutynib. Niestety, kiedy te metody nie są dostępne, chorych zmuszeni jesteśmy leczyć immunochemioterapią.
Tylko ta grupa pacjentów, która nie ma delecji 17p/mutacji TP53 i ma niezmutowany status genów IGVH jest u nas leczona prawidłowo. Dla młodszych chorych zalecana jest terapia FCR/CCR lub BR, dla osób starszych z chorobami współistniejącymi najlepszy byłby wenetoklaks z obinutuzumabem, nierefundowany w Polsce. Inne opcje to: scu ChlG, ibrutynib, akalabrutynib.
U chorych na nawrotową przewlekłą białaczkę limfocytową ze wskazaniami do leczenia, obecność delecji 17p/ mutacji TP53 definiuje wybór leczenia. Jeśli pacjent ma taką mutację, może otrzymać w Polsce nowe terapie celowane. Kiedy nawrót choroby nastąpi do 36 miesięcy od rozpoczęcia terapii 1. linii, pacjent nie powinien otrzymać immunochemioterapii, tylko leki celowane – ibrutynib, akalabrutynib, wenetoklaks z rytuksymabem, sam wenetoklaks czy idelalizyb z rytuksymabem. Jednak kiedy ten nawrót nastąpi po 36 miesiącach od rozpoczęcia terapii 1. linii, możemy powtórzyć imunochemioterapię. Natomiast ibrutynib, akalabrutynib, wenetoklaks z rytuksymabem, idelalizyb z rytuksymabem, są to również korzystne opcje.
W Polsce program lekowy zakłada, że nawrót choroby musi nastąpić w ciągu 24 miesięcy (nie 36 miesięcy) po leczeniu 1. linii, aby pacjent otrzymał nowe terapie celowane. Natomiast, kiedy chory otrzymał 2, 3 linie immunochemioterapii i nastąpił nawrót, a pacjent wyczerpał możliwości leczenia, ale miał dłuższą odpowiedź niż 6 miesięcy, wtedy nie możemy zastosować nowych terapii celowanych. Niestety odbiegamy od standardów, a największym problemem jest leczenie 1. linii.
Mówimy, że terapia onkologiczna ma dużą wartość w 1. linii, co się składa na tę wartość w przypadku leczenia pacjentów z przewlekłą białaczką limfocytową?
Jak już powiedziałam, w 1. linii nie powinno się stosować immunochemioterapii w przypadku delecji 17p/mutacji TP53. Dużo bardziej skorzystaliby z leczenia nowymi cząsteczkami również chorzy z niezmutowanym statusem genów dla IGVH. Natomiast gdy mówimy ogólnie o leczeniu w 1. linii i chorych, którzy nie kwalifikują się do intensywnej imunochemioterapii, schematem zalecanym dla pacjentów jest wenetoklaks z obinutuzumabem, na podstawie wyniku badania klinicznego CLL 14, które pokazało, że ta skuteczność jest znacznie większa od terapii, którą mamy w programie, czyli obinutuzumabu z chlorambucylem. Po pierwsze, leczenie trwa rok, więc jest to terapia nowymi cząsteczkami ograniczona w czasie. Jest to leczenie bez chemioterapii, które pozwala u większości chorych na uzyskanie głębokiej odpowiedzi, eliminację minimalnej choroby resztkowej, więc ci chorzy mogą zostawać dłuższy czas bez leczenia. Na tym polega szczególna korzyść dla tej grupy pacjentów. Ponadto, leczenie to jest dobrze tolerowane.
Na czym polega mechanizm działania tej terapii nowej generacji? Czy mogą stosować ją pacjenci bez względu na wynik badań cytogenetycznych?
W schemacie stosuje się wenetoklaks z obinutuzumabem, nowym przeciwciałem monoklonalnym skierowanym przeciwko antygenowi na komórce nowotworowej – cząsteczce CD-20. Jest ono silniejsze niż stosowany od wielu lat rytuksymab. Działanie terapii wenetoklaksem (inhibitor białka BCL2), wiąże się z tym, że komórki nowotworowe przewlekłej białaczki limfocytowej żyją znacznie dłużej niż zwykłe limfocyty. Kiedyś mówiło się, że to przede wszystkim choroba z akumulacji, a nie z proliferacji, obecnie wiemy jednak, że te komórki również proliferują. Dłuższe przeżycie wynika z zaburzeń równowagi między białkami, które decydują o wejściu na drogę programowanej śmierci komórki (apoptozę), a tymi które ją hamują. W przewlekłej białaczce limfocytowej, podobnie jak w innych nowotworach jest przeciwwaga białek, które hamują apoptozę, czyli białek antyapoptycznych. Jeżeli wenetoklaks zahamuje białko antyapoptyczne przeciwdziałające śmierci komórek, wtedy uruchamiane są procesy prowadzące do apoptozy. W ten sposób komórka nowotworowa ginie. Jeśli ten lek stosowany jest w monoterapii, wymagane jest leczenie w sposób ciągły. Natomiast dołączenie przeciwciała monoklalnego sprawia, że uzyskujemy głębszą odpowiedź. Dochodzi do eliminacji minimalnej choroby resztkowej. W leczeniu opornej/nawrotowej przewlekłej białaczki limfocytowej, wenetoklaks stosowany jest w połączeniu z rytuksymabem.
Mechanizm działania wenetoklaksu jest uniwersalny, dzięki czemu wenetoklaks jest już również zarejestrowany w ostrej białaczce szpikowej i badany jest u chorych na szpiczaka. Są też prowadzone badania kliniczne w innych wskazaniach. Jest to więc bardzo rozwojowa cząsteczka, przy czym największe korzyści odnosimy z jej podania w 1. linii.
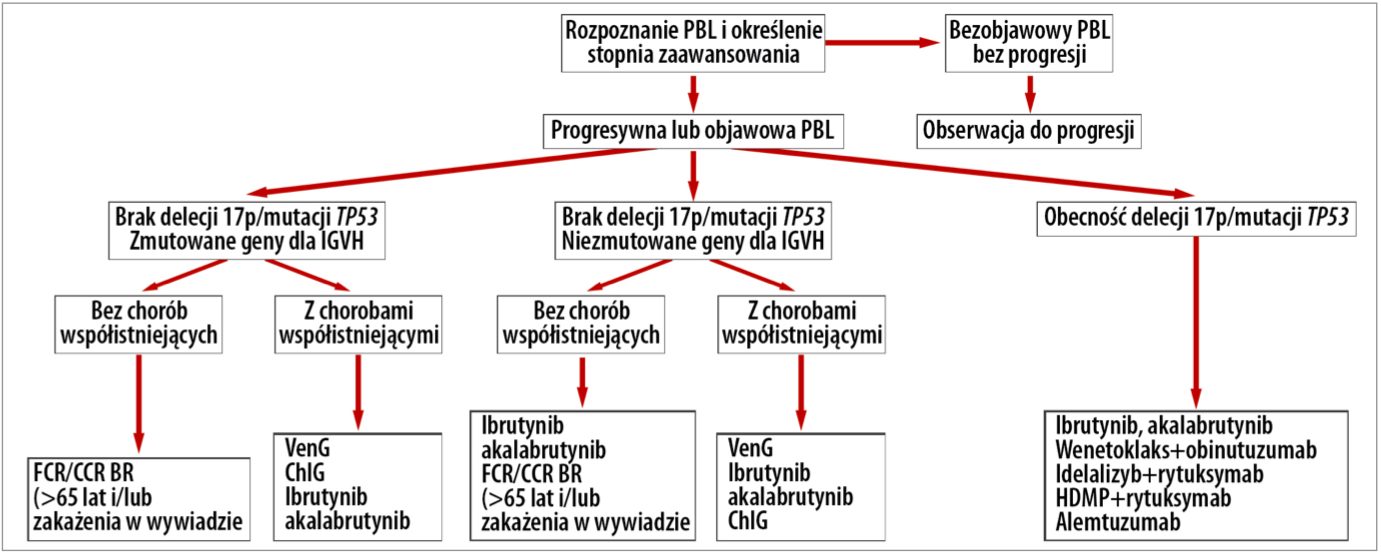
Wytyczne PTHiT leczenia 1. linii pacjentów z PBL
Prof. dr hab. n. med. Iwona Hus jest specjalistką chorób wewnętrznych, hematologii i onkologii klinicznej. Główne kierunki jej zainteresowań naukowych i klinicznych to zagadnienia dotyczące immunobiologii, leczenia chorób limfoproliferacyjnych, immunoterapii przeciwnowotworowej u chorych na przewlekłą białaczkę limfocytową, leczenia immunomodulującego u chorych na szpiczaka plazmocytowego. Prof. Hus pracowała w Klinice Hematoonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie, a obecnie jest kierownikiem Oddziału Chorób Układu Chłonnego w Instytucie Hematologii i Transfuzjologii w Warszawie. Jest autorką i współautorką ponad 210 publikacji z zakresu hematologii, onkologii i immunologii klinicznej oraz recenzentem w polskich i międzynarodowych czasopismach naukowych. Od 2019 r. pełni funkcję prezesa Polskiego Towarzystwa Hematologów i Transfuzjologów.
Źródło: Głos Pacjenta Onkologicznego 2/2021