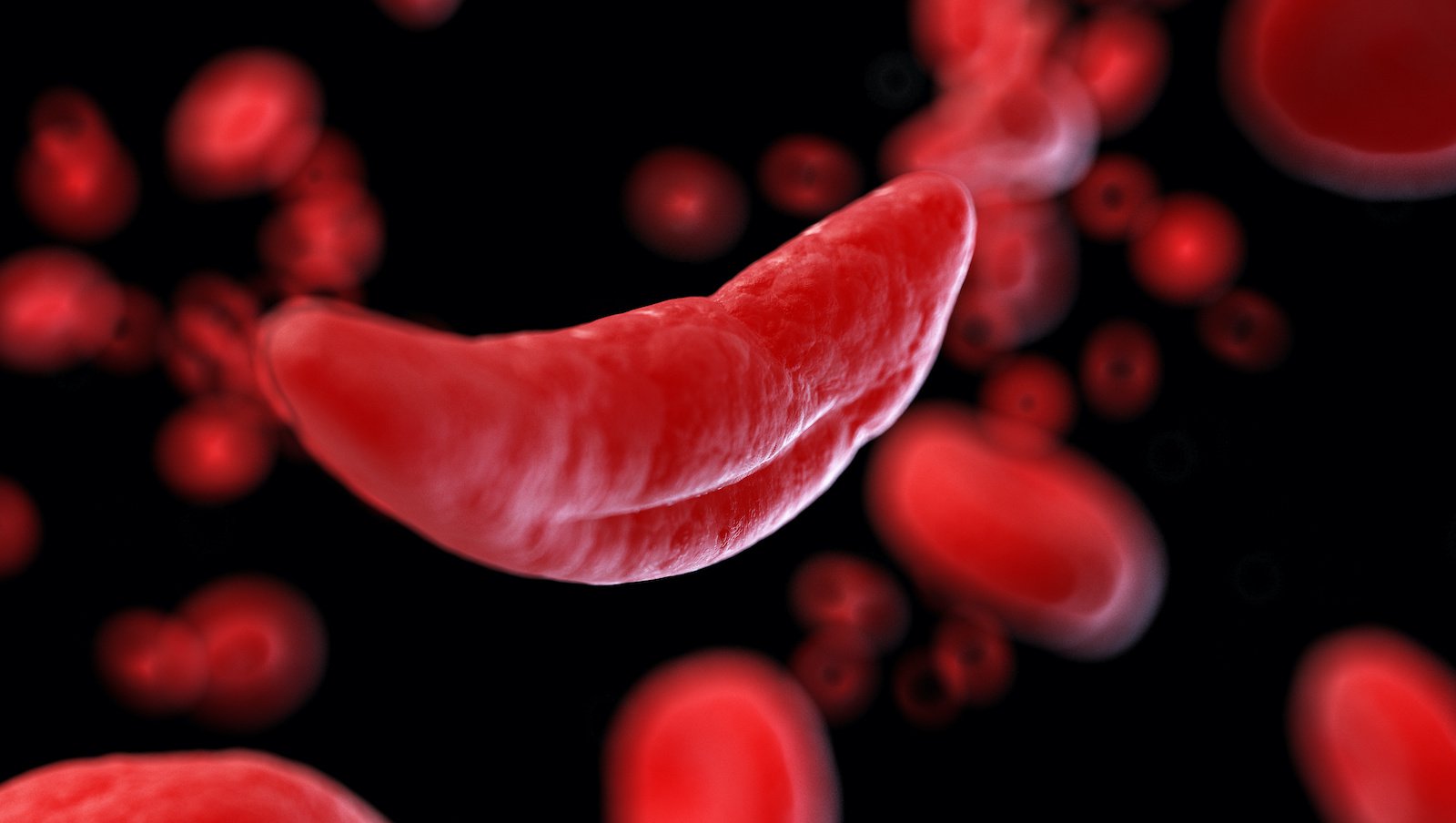
We wrześniu br. firma Global Blood Therapeutics, Inc. ogłosiła, że amerykańska Agencja ds. Żywności i Leków (Food and Drug Administration, FDA) zaakceptowała wniosek uzupełniający o zatwierdzenie nowego leku, w którym firma ubiega się o przyspieszone zatwierdzenie preparatu Oxbryta® (voxelotor) do leczenia niedokrwistości sierpowatokrwinkowej (sickle cell disease, SCD) u dzieci w wieku od 4 do 11 lat oraz wniosek o zatwierdzenie nowego leku dotyczący leku Oxbryta w formie rozpuszczalnej tabletki odpowiedniej dla pacjentów pediatrycznych.
Materiał przeznaczony wyłącznie dla pracowników służby zdrowia
Ten materiał jest dostępny dla zarejestrowanych użytkowników.
Zaloguj się
Szanowni użytkownicy,
część materiałów udostępnianych na naszym portalu jest przeznaczona
wyłącznie dla lekarzy.
Wynika to z regulacji prawnych, do których musimy się stosować.
Jeśli nie jesteś lekarzem, zachęcamy do korzystania z przygotowanych przez nas materiałów dostępnych w zakładce dla pacjentów.







